در کریستالوگرافی ، سیستم کریستالی مکعبی (یا ایزومتریک ) یک سیستم کریستالی است که سلول واحد به شکل یک مکعب است . این یکی از رایج ترین و ساده ترین اشکال موجود در کریستال ها و مواد معدنی است .
سه نوع اصلی از این کریستال ها وجود دارد:
- مکعب اولیه (به اختصار cP و به طور متناوب به آن مکعب ساده می گویند )
- مکعب در مرکز بدن (به اختصار cI یا bcc )
- مکعب فیس وسط (به اختصار cF یا fcc )
توجه: اصطلاح fcc اغلب به صورت مترادف برای ساختار مکعبی بسته بندی شده یا ccp که در فلزات وجود دارد استفاده می شود. با این حال، fcc مخفف شبکه Bravais مکعبی وجهی در مرکز است، که وقتی یک موتیف روی نقاط شبکه قرار میگیرد، لزوماً بسته نیست. به عنوان مثال، الماس و شبکه های زینکبلند fcc هستند اما بسته بندی نشده اند. هر کدام به انواع دیگری که در زیر فهرست شده اند تقسیم می شوند. اگرچه سلولهای واحد در این کریستالها معمولاً مکعبی در نظر گرفته میشوند، سلولهای واحد اولیه اغلب اینطور نیستند.

شبکه های Bravais
سه شبکه Bravais در سیستم کریستالی مکعبی عبارتند از:
| شبکه Bravais | مکعب اولیه | مکعب بدنه محور | مکعب وسط صورت |
|---|---|---|---|
| نماد پیرسون | cP | cI | cF |
| سلول واحد |  |
 |
 |
شبکه مکعبی اولیه (cP) از یک نقطه شبکه در هر گوشه مکعب تشکیل شده است. این بدان معناست که هر سلول واحد مکعبی ساده در مجموع یک نقطه شبکه دارد. سپس هر اتم در یک نقطه شبکه به طور مساوی بین هشت مکعب مجاور تقسیم می شود و بنابراین سلول واحد در مجموع دارای یک اتم ( 8 × 1⁄8 ) است.
شبکه مکعبی مرکز بدن (cI) علاوه بر هشت نقطه گوشه، یک نقطه شبکه در مرکز سلول واحد دارد. دارای مجموع خالص دو نقطه شبکه در هر سلول واحد ( 1 ⁄ 8 × 8 + 1).
شبکه مکعبی وجهی محور (cF) دارای نقاط شبکه ای در وجوه مکعب است که هر کدام دقیقاً نیمی از سهم را به اضافه نقاط شبکه گوشه ای دارند و در مجموع 4 نقطه شبکه در هر سلول واحد ( 1 × 8 × 1/8 ) می دهند. 8 از گوشه ها به علاوه 1 ⁄ 2 × 6 از چهره).
شبکه مکعبی وجه محور ارتباط نزدیکی با سیستم بسته بندی نزدیک شش ضلعی (hcp) دارد، که در آن دو سیستم تنها در قرارگیری نسبی لایه های شش ضلعی خود متفاوت هستند. صفحه [111] یک شبکه مکعبی رو به مرکز، یک شبکه شش ضلعی است.
تلاش برای ایجاد یک شبکه مکعبی با مرکز پایه (یعنی قرار دادن یک نقطه شبکه اضافی در مرکز هر وجه افقی) منجر به یک شبکه چهارضلعی ساده Bravais می شود .
عدد هماهنگی (CN) تعداد نزدیکترین همسایگان یک اتم مرکزی در ساختار است. هر کره در یک شبکه cP دارای شماره هماهنگی 6، در یک شبکه cI 8 و در یک شبکه cF 12 است.
ضریب بسته بندی اتمی (APF) کسری از حجم است که توسط اتم ها اشغال می شود. شبکه cP دارای APF حدود 0.524، شبکه cI APF حدود 0.680 و شبکه cF APF حدود 0.740 است.

کلاس های کریستال
نامهای کلاس سیستم بلورهای ایزومتریک ، گروههای نقطهای (در نماد Schönflies ، نماد Hermann-Mauguin ، نماد orbifold و Coxeter )، نوع، مثالها، جداول بینالمللی برای شماره گروه فضای کریستالوگرافی، [2] و گروههای فضایی در جدول زیر فهرست شدهاند. . در مجموع 36 گروه فضایی مکعبی وجود دارد.
| خیر | گروه نقطه | تایپ کنید | مثال | گروه های فضایی | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| نام [3] | شون. | بین المللی | گوی. | کاکس | اولیه | چهره محور | بدن محور | |||
| 195-197 | چهارتایی | تی | 23 | 332 | [3،3] + | انانتیومورفیک | اولمانیت ، کلرات سدیم | P23 | F23 | I23 |
| 198-199 | P2 1 3 | I2 1 3 | ||||||||
| 200-204 | دیپلوئیدی | T h | 2/m 3 (m 3 ) |
3*2 | [3 + ,4] | مرکز متقارن | پیریت | بعد از ظهر 3 ، Pn 3 | Fm 3 , Fd 3 | من 3 |
| 205-206 | پا 3 | Ia 3 | ||||||||
| 207-211 | ژیرویدال | O | 432 | 432 | [3،4] + | انانتیومورفیک | پتزیت | P432 ، P4 2 32 | F432، F4 1 32 | I432 |
| 212-214 | P4 3 32, P4 1 32 | I4 1 32 | ||||||||
| 215-217 | شش وجهی | T d | 4 3 متر | *332 | [3،3] | اسفالریت | P 4 3m | F 4 3 متر | من 4 3 متر | |
| 218-220 | P 4 3n | F 4 3c | من 4 3 بعدی | |||||||
| 221-230 | شش وجهی | اوه | 4/m 3 2/m (m 3 m) |
*432 | [3،4] | مرکز متقارن | گالن ، هالیت | Pm 3 m, Pn 3 n, Pm 3 n , Pn 3 m | Fm 3 m , Fm 3 c, Fd 3 m, Fd 3 c | من 3 متر، Ia 3 روز |
اصطلاحات دیگر برای hexoctahedral عبارتند از: کلاس عادی، holohedral ، کلاس مرکزی ditesseral، نوع galena .
ساختارهای تک عنصری
به عنوان یک قاعده، از آنجایی که اتمها در یک جامد یکدیگر را جذب میکنند، آرایش محکمتر اتمها متداولتر است. (هر چند، برای مثال اگر هیبریداسیون مداری به زوایای پیوند خاصی نیاز داشته باشد، آرایشهای بستهشده رخ میدهند .) بر این اساس، ساختار مکعبی اولیه، با فاکتور بستهبندی اتمی پایین، در طبیعت نادر است، اما در پولونیوم یافت میشود . [4] [5] bcc و fcc ، با چگالی بالاتر، هر دو در طبیعت بسیار رایج هستند . نمونه هایی از bcc شامل آهن ، کروم ، تنگستن و نیوبیم است . نمونه هایی از fcc عبارتند از آلومینیوم ، مس ، طلا و نقره .
یکی دیگر از ساختارهای کریستالی مکعبی مهم ، ساختار مکعبی الماس است که می تواند در کربن ، سیلیکون ، ژرمانیوم و قلع ظاهر شود . برخلاف fcc و bcc، این ساختار یک شبکه نیست، زیرا حاوی چندین اتم در سلول اولیه خود است . دیگر ساختارهای عنصری مکعبی شامل ساختار A15 موجود در تنگستن و ساختار بسیار پیچیده منگنز است .

ساختارهای چند عنصری
ترکیباتی که از بیش از یک عنصر تشکیل شده اند (مثلا ترکیبات دوتایی ) اغلب دارای ساختارهای کریستالی بر اساس سیستم کریستالی مکعبی هستند. برخی از موارد رایج در اینجا ذکر شده است. این ساختارها را می توان به عنوان دو یا چند زیرشبکه متقابل در نظر گرفت که در آن هر زیرشبکه مکان های بین بافتی دیگران را اشغال می کند.
ساختار کلرید سزیم
یک ساختار، ساختار مکعبی بدوی متقابل است که به آن ساختار «سزیم کلرید» یا B2 نیز میگویند. این ساختار اغلب برای یک ساختار مکعبی در مرکز بدن اشتباه گرفته می شود زیرا آرایش اتم ها یکسان است. با این حال، ساختار کلرید سزیم دارای پایه ای است که از دو گونه اتمی مختلف تشکیل شده است. در یک ساختار مکعبی بدن محور، تقارن انتقالی در امتداد جهت [111] وجود خواهد داشت. در ساختار کلرید سزیم، ترجمه در جهت [111] منجر به تغییر گونه می شود. این ساختار همچنین می تواند به عنوان دو ساختار مکعبی ساده مجزا، یکی از هر گونه، در نظر گرفته شود که درون یکدیگر قرار گرفته اند. گوشه مکعب کلرید مرکز مکعب سزیم است و بالعکس. [6]
برای ساختار NaCl که در بخش بعدی توضیح داده شده است، به همین ترتیب عمل می کند. اگر اتمهای کلر را بیرون بیاورید، اتمهای باقیمانده Na همچنان یک ساختار FCC تشکیل میدهند، نه یک ساختار مکعبی ساده.
در سلول واحد CsCl، هر یون در مرکز مکعبی از یونهای مخالف قرار دارد، بنابراین عدد هماهنگی هشت است. کاتیون مرکزی مطابق شکل با 8 آنیون در گوشه های یک مکعب هماهنگ می شود و به طور مشابه، آنیون مرکزی با 8 کاتیون در گوشه های یک مکعب هماهنگ می شود. متناوبا، می توان این شبکه را به عنوان یک ساختار مکعبی ساده با یک اتم ثانویه در فضای خالی مکعبی آن مشاهده کرد .
علاوه بر کلرید سزیم، این ساختار در برخی از هالیدهای قلیایی دیگر نیز ظاهر می شود که در دماهای پایین یا فشار بالا آماده شوند. [7] به طور کلی، این ساختار بیشتر احتمال دارد که از دو عنصر تشکیل شود که یونهای آنها تقریباً هم اندازه هستند (به عنوان مثال، شعاع یونی Cs + = 167 pm و Cl- = 181 pm).
گروه فضایی ساختار کلرید سزیم (CsCl) Pm 3 متر (در نماد هرمان-موگن ) یا “221” (در جداول بین المللی کریستالوگرافی) نامیده می شود . نام Strukturbericht ” B2″ است. [8]
نزدیک به صد ترکیب بین فلزی خاکی کمیاب وجود دارد که در ساختار CsCl متبلور می شوند، از جمله بسیاری از ترکیبات دوتایی خاک های کمیاب با منیزیم ، [9] و با عناصر گروه 11 ، 12 ، [10] [11] و 13 . سایر ترکیباتی که ساختاری شبیه کلرید سزیم دارند عبارتند از CsBr ، CsI ، RbCl با دمای بالا ، AlCo، AgZn، BeCu، MgCe، RuAl و SrTl. [ نیازمند منبع ]
ساختار سنگ نمک [ ویرایش ]
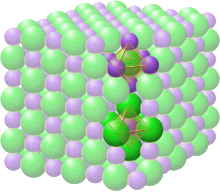
گروه فضایی ساختار سنگ نمک یا هالیت (کلرید سدیم) به عنوان Fm 3 (در نماد هرمان-موگن )، یا “225” (در جداول بین المللی کریستالوگرافی) نشان داده می شود. نام Strukturbericht ” B1″ است. [12]
در ساختار سنگ نمک، هر یک از دو نوع اتم، یک شبکه مکعبی متمرکز روی صورت مجزا را تشکیل میدهند، که دو شبکه بهطور متقابل نفوذ میکنند تا یک الگوی شطرنجی سهبعدی را تشکیل دهند. ساختار سنگ نمک دارای هماهنگی هشت وجهی است : نزدیکترین همسایگان هر اتم از شش اتم از نوع مخالف تشکیل شده است که مانند شش راس یک هشت وجهی منظم قرار گرفته اند . در کلرید سدیم نسبت 1:1 اتم های سدیم به کلر وجود دارد. این ساختار همچنین می تواند به عنوان یک شبکه FCC از سدیم با کلر که هر فضای خالی هشت وجهی را اشغال می کند یا بالعکس توصیف شود. [6]
نمونههایی از ترکیبات با این ساختار عبارتند از خود کلرید سدیم، به همراه تقریباً تمام هالیدهای قلیایی دیگر، و “بسیاری از اکسیدهای فلزی دو ظرفیتی، سولفیدها، سلنیدها و تلوریدها”. [7] طبق قانون نسبت شعاع ، اگر کاتیون تا حدودی کوچکتر از آنیون باشد (نسبت شعاع کاتیون/آنیون 0.414 تا 0.732) احتمال تشکیل این ساختار بیشتر است.
فاصله بین اتمی (فاصله بین کاتیون و آنیون، یا نصف طول واحد سلول a ) در برخی از بلورهای ساختار سنگ نمک عبارتند از: 2.3 Å (2.3 × 10-10 متر ) برای NaF، [13] 2.8 Å برای NaCl، [ 13]. 14] و 3.2 Å برای SnTe. [15] بیشتر هیدریدها و هالیدهای فلز قلیایی ساختار سنگ نمک دارند، اگرچه تعداد کمی از آنها ساختار کلرید سزیم را دارند .
بسیاری از مونوکسیدهای فلزات واسطه ساختار نمک سنگی نیز دارند ( TiO , VO , CrO , MnO , FeO , CoO , NiO , CdO ). مونوکاربیدهای اکتینوئید اولیه نیز این ساختار را دارند ( ThC ، PaC ، UC ، NpC ، PuC ). [37]
ساختار فلوریت
مانند ساختار سنگ نمک، ساختار فلوریت (AB 2 ) نیز یک ساختار Fm 3 متری است اما دارای نسبت 1:2 یون است. ساختار ضد فلوریت تقریباً یکسان است، به جز موقعیت های آنیون ها و کاتیون ها در ساختار تغییر می کند. آنها در موقعیت های Wyckoff 4a و 8c تعیین می شوند در حالی که موقعیت های ساختار سنگ نمک 4a و 4b هستند. [48] [49]
ساختار زینکبلند [ ویرایش ]

گروه فضایی سازه Zincblende F 4 3m (در نماد Hermann-Mauguin ) یا 216 نامیده می شود. [50] [51] نام Strukturbericht “B3” است. [52]
ساختار Zincblende (همچنین “Zinc Blende” نیز نوشته میشود) از کانی zincblende ( اسفالریت )، یکی از شکلهای سولفید روی (β-ZnS) نامگذاری شده است. همانطور که در ساختار سنگ نمک، دو نوع اتم دو شبکه مکعبی متقابل رو به مرکز را تشکیل می دهند. با این حال، با ساختار سنگ نمک در نحوه قرارگیری دو شبکه نسبت به یکدیگر متفاوت است. ساختار زینکبلند دارای هماهنگی چهار وجهی است : نزدیکترین همسایگان هر اتم از چهار اتم از نوع مخالف تشکیل شده است که مانند چهار راس یک چهار وجهی منظم قرار گرفته اند . در سولفید روی نسبت روی به گوگرد 1:1 است. [6] در مجموع، آرایش اتمها در ساختار زینکبلند مانند ساختار مکعبی الماس است ، اما با انواع متناوب اتمها در محلهای مختلف شبکه. این ساختار همچنین می تواند به عنوان یک شبکه FCC از روی با اتم های گوگرد که نیمی از حفره های چهار وجهی را اشغال می کند یا بالعکس توصیف شود. [6]
نمونه هایی از ترکیبات با این ساختار عبارتند از خود زینبلند، نیترات سرب(II) ، بسیاری از نیمه هادی های ترکیبی (مانند آرسنید گالیم و تلورید کادمیوم )، و مجموعه وسیعی از ترکیبات دوتایی دیگر. [ نیاز به ذکر منبع ] پنیکتوژنیدهای گروه بور معمولاً دارای ساختار روی بلوند هستند، اگرچه نیتریدها در ساختار wurtzite رایجتر هستند و اشکال زینبلند آنها چند شکلهای کمتر شناخته شده هستند . [53] [54]
| فلوراید | کلریدها | برومیدها | یدیدها | |
|---|---|---|---|---|
| فلز مس | فلوراید مس (I). | کلرید مس (I). | برمید مس (I). | یدید مس (I). |
| سولفیدها | سلنیدها | تلوریدس | پولونیدها | |
|---|---|---|---|---|
| بریلیم | سولفید بریلیم | سلنید بریلیم | بریلیم تلورید | بریلیم پولونید [55] [56] |
| فلز روی | سولفید روی | سلنید روی | تلورید روی | روی پولونید |
| کادمیوم | سولفید کادمیوم | سلنید کادمیوم | تلورید کادمیوم | پلونید کادمیوم |
| سیاره تیر | سولفید جیوه | سلنید جیوه | تلورید جیوه | – |
این گروه همچنین به عنوان خانواده ترکیبات II-VI شناخته می شود که بیشتر آنها را می توان به دو شکل زینکبلند (مکعبی) یا وورتزیت (هگزاگونال) ساخت.
| نیتریدها | فسفیدها | آرسنیدها | آنتیمونیدها | |
|---|---|---|---|---|
| بور | نیترید بور * | فسفید بور | آرسنید بور | آنتیمونید بور |
| آلومینیوم | نیترید آلومینیوم * | فسفید آلومینیوم | آرسنید آلومینیوم | آنتیمونید آلومینیوم |
| گالیوم | نیترید گالیوم * | فسفید گالیم | آرسنید گالیم | آنتیمونید گالیم |
| ایندیوم | نیترید ایندیم * | ایندیم فسفید | آرسنید ایندیوم | آنتیمونید ایندیوم |
این گروه به خانواده ترکیبات III-V نیز معروف است .

ساختار هوسلر [ ویرایش ]
ساختار هوسلر، بر اساس ساختار Cu 2 MnAl، یک ساختار رایج برای ترکیبات سه تایی شامل فلزات واسطه است . دارای گروه فضایی Fm 3 متر (شماره 225) و نام Strukturbericht L2 1 است . همراه با ترکیبات نیمه هوسلر و معکوس هوسلر نزدیک به هم، صدها مثال وجود دارد.
ساختار مونوسیلید آهن [ ویرایش ]

گروه فضایی ساختار تک سیلیس آهن P2 1 3 (شماره 198) و نام Strukturbericht B20 است. این یک ساختار کایرال است و گاهی اوقات با خواص هلی مغناطیسی همراه است. چهار اتم از هر عنصر در مجموع هشت اتم در سلول واحد وجود دارد.
نمونههایی در میان سیلیسیدها و ژرمانیدهای فلزات واسطه و همچنین چند ترکیب دیگر مانند پالادید گالیوم وجود دارد .
| سیلیسیدها | ژرمنیدس | |
|---|---|---|
| منگنز | مونو سیلیس منگنز | ژرمانید منگنز |
| اهن | مونوسیل کش آهن | ژرمانید آهن |
| کبالت | مونو سیلیس کبالت | کبالت ژرمانید |
| کروم | سیلیسید کروم (IV). | کروم (IV) ژرمانید |
ساختار Weaire–Phelan

ساختار Weaire-Phelan دارای تقارن Pm 3 n (223) است.
دارای سه جهت چهارده وجهی انباشته با سلولهای پیریتوهدرال در شکافها است. این به عنوان یک ساختار بلوری در شیمی یافت می شود که معمولاً به عنوان ” ساختار clathrate نوع I” شناخته می شود. هیدرات های گازی که توسط متان، پروپان و دی اکسید کربن در دماهای پایین تشکیل می شوند، ساختاری دارند که در آن مولکول های آب در گره های ساختار Weaire-Phelan قرار دارند و با هم پیوند هیدروژنی دارند ، و مولکول های گاز بزرگتر در قفس های چند وجهی به دام افتاده اند.